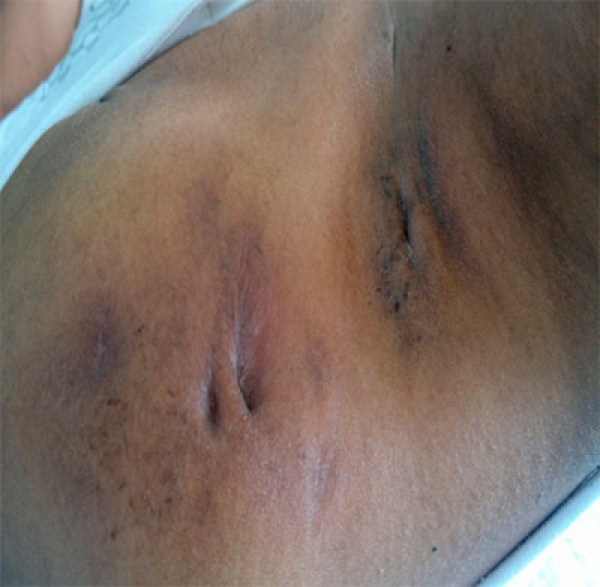
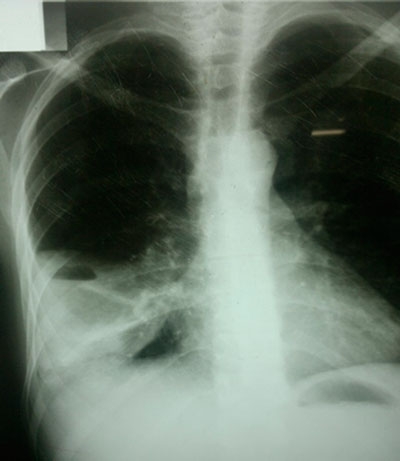
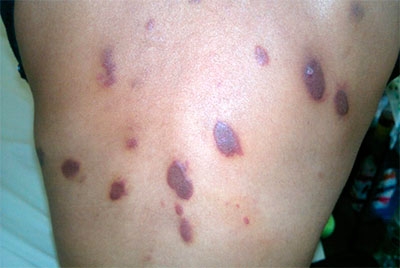
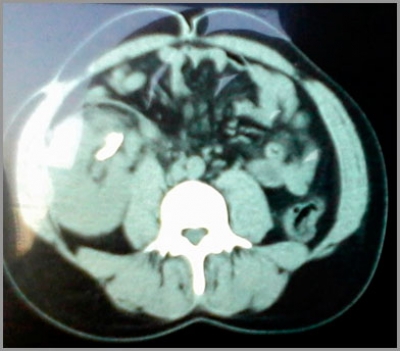
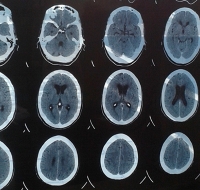
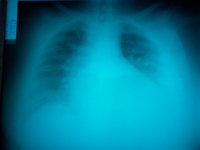
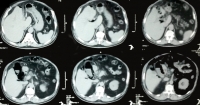
Absceso hepático
Dr. Martín López, Dra. Daniela Paciel
Tuberculosis cutánea
Rhodococcus equi. Neumonia
-
Rhodococcus equi. Neumonia
(
 Descargas)
Descargas)
Sarcoma de Kaposi
Sepsis nefrourológica por BGN productor de carbapenemasas NDM
Comentario al artículo de Pedro Cahn et al. publicado en Lancet Infect Dis 2014. Estudio GARDEL
Pedro Cahn et al. Dual Therapy with lopinavir and ritonavir plus lamivudine versus triple therapy with lopinavir and ritonavir plus two nuclesoside reverse transcriptase inhibitors in antiretroviral therapy naive adults with HIV 1 infections: 48 week results of the randomised, open label, non inferiority GARDEL trial.
Lancet Infect Dis 2014
http://dx.doi.org/10.1016/S1473-3099(14)70736-4
Comentario realizado por Asistente de Cátedra Dra. Mariana Guirado
GARDEL es un estudio conducido por investigadores argentinos, publicado en Lancet Infectious Diseases en julio de 2014. Es un estudio de fase III, de no inferioridad, aleatorizado, controlado, abierto, multicéntrico e internacional (Argentina, Perú, Chile, Estados Unidos, España y México). Comparó un régimen de tratamiento dual con lopinavir-ritonavir (LPV-r) y lamivudina (3TC) o emtricitabina (FTC) con el tratamiento de triterapia con LPV-r junto con 3TC ó FTC y un tercer fármaco inhibidor nucleosídico/nucleotídico de la transcriptasa inversa (INTI): zidovudina (AZT), tenofovir (TDF) o abacavir (ABC). Se valoró la seguridad, tolerabilidad, actividad antiviral y emergencia de resistencia entre ambos planes terapéuticos durante las 48 semanas del estudio.
Se incluyeron 416 pacientes adultos infectados por VIH-1, naive, con más de 1000 copias de ARN viral/mL. Se excluyeron pacientes con antígeno de superficie positivo del virus de hepatitis B, pacientes embarazadas o en lactancia, pacientes con abuso de alcohol o drogas, con comorbilidad o alteraciones de laboratorio significativas. También se excluyeron los pacientes con evidencia de resistencia a LPV-r, 3TC o FTC.
Los principales resultados muestran ausencia de inferioridad de la terapia dual vs. la triterapia estándar. Así, la carga viral (CV) indetectable fue similar entre ambos grupos (CV<50 copias/mL a las 48 semanas 88,3% en terapia dual y 83,7% en el grupo de triple terapia. IC95%: -2,2 a 11,8; p=0,171). Los pacientes con CV >100.000 copias/mL mostraron resultados similares (87,2% vs. 77,9%, respectivamente. IC95%: -2,8 a 21,5; p=0,145).
El incremento medio del conteo de linfocito T CD4+ desde el valor basal a la semana 48 fue: 227 células/mL en el grupo de terapia dual vs. 217 células/mL en el de triple terapia (p=0,625). Veintidos pacientes presentaron falla virológica: 4,7% en el grupo de terapia dual vs. 5,9% en triterapia (p=0,720). No se identificaron mutaciones asociadas a inhibidores de proteasa en ninguno de los dos brazos del estudio.
La mayoría de los pacientes experimentaron al menos un evento adverso. Ciento cincuenta y tres (153) eventos adversos fueron posible o probablemente relacionados a medicamentos: 65 en el grupo de biterapia vs. 88 en triterapia (p= 0,007). Los más comunes fueron: hiperlipidemia, diarrea, náuseas y dispepsia. Las discontinuaciones del tratamiento vinculadas a toxicidad o tolerancia fueron más frecuentes en la triterapia que en la terapia dual (4,9% vs. 0,4%; IC95%: -8,1 a -0,9; p=0,01). Un paciente falleció debido a sepsis (terapia dual).
Dentro de las principales conclusiones del presente trabajo se destaca que la terapia dual es no inferior en términos de supresión viral independientemente de la CV basal. La resistencia a drogas antirretrovirales fue infrecuente en ambos brazos del estudio.
Así, tras 48 semanas la terapia dual mostró similar eficacia a la triple terapia con la ventaja de menores efectos adversos y menor tasa de discontinuación. Se resalta la potencial menor toxicidad, requiriendo menos controles y costos; además, permitiría “reservar” otros INTI para terapias de segunda línea.
Las principales limitaciones de este trabajo se vinculan a que se trata de un estudio de no inferioridad, abierto, con financiación por parte de la industria farmaceútica. A esto se agrega que la determinación de la carga viral se realizó en cada centro y que el tercer fármaco de la triterapia fue a discreción del investigador, utilizándose AZT en más de la mitad de los casos.
Cabe destacar que este trabajo abre nuevas perspectivas en el tratamiento antirretroviral, tanto en lo que refiere al tratamiento inicial como a terapia de desintensificación. La terapia dual podría ser de particular utilidad para quienes experimentan toxicidad vinculada al uso de AZT, ABC o TDF.
Este trabajo actualmente continúa hasta completar 96 semanas y se están realizando estudios con otras combinaciones en biterapia.
Trastornos neurocognitivos (TNC) asociados a VIH
Neumonía en TOS
Colecistitis enfisematosa
Lima ALL, et al. Recommendations for the treatment of osteomyelitis. Braz J Infect Dis. 2014.
Lima ALL, et al.
Recommendations for the treatment of osteomyelitis. Braz J Infect Dis. 2014.
Comentario realizado por Asist. Cátedra Dra. Karina Tenaglia
La osteomielitis, definida como la inflamación del tejido óseo secundario a un proceso infeccioso, es una patología de diagnóstico y tratamiento dificultoso. Requiere el abordaje por un equipo multidisciplinario integrado por traumatólogo, internista, infectólogo, microbiólogo e imagenólogos para lograr el éxito terapéutico. Las principales formas de presentación son la osteomielitis aguda (OMA) que predomina en la población pediátrica y la osteomielitis crónica (OMC) sobre todo en la población adulta. La actual epidemia de accidentes de tránsito ha determinado un aumento de la osteomielitis crónica vinculada a material de osteosíntesis representando el 45-50% de las OMC postraumáticas.
Estas recomendaciones a través del análisis de 3 puntos claves nos dan herramientas útiles a la hora de enfrentarnos a un caso de osteomielitis:
1) ¿Qué clasificación usar?
Para el manejo clínico es útil la clasificación de Waldvogel que toma en cuenta la vía de llegada del microorganismo al hueso: hematógena, por contigüidad o por inoculación directa. También considera el tiempo de evolución para clasificarla en aguda o crónica.
La clasificación de Cierny y Mader da una visión anatómica de la enfermedad y considera el terreno del paciente. Contempla la presencia o ausencia de comorbilidad local o sistémica del huésped, topografía la lesión, ve su extensión y la estabilidad del tejido óseo, siendo útil cuando planteamos un abordaje quirúrgico.
2) ¿Cuáles son las pruebas diagnósticas a solicitar y su rendimiento?
En el diagnóstico el gold estándar es el hallazgo de microorganismos en el tejido óseo. Esta técnica tiene un bajo rendimiento, razón por la que el diagnóstico se construye en base a la suma de pilares clínicos y paraclínicos.
La presentación clínica es variable, con dolor y fiebre en los cuadros agudos, sólo dolor en las formas crónicas o la presencia de fístula cuando existe material de osteosíntesis.
Dentro de la paraclínica los reactantes de fase aguda PCR y VES son muy sensibles pero poco específicos, es decir son más útiles para el seguimiento del paciente. La interleuquina 6 es uno de los biomarcadores utilizado en las infecciones vinculadas a material protésico.
La histología de las muestras nos orienta a un proceso agudo cuando predominan los leucocitos polimorfonucleares y a cronicidad los infiltrados linfocitarios. Tiene un rendimiento de 50% en infecciones vinculadas a material protésico cuando el hallazgo es mayor a 5 leucocitos por campo con una sensibilidad variable de 43-84% y especificidad de 93-97%.
Las muestras y el análisis microbiológico deben cumplir una serie de condiciones para aumentar su rendimiento:
- El paciente debe estar sin cobertura antimicrobiana, si lo estaba recibiendo suspenderlo 2 semanas previas al procedimiento, si la situación clínica del paciente así lo permite.
- Obtener 3 muestras como mínimo, cuando hay material protésico se recomiendan 6 muestras.
- Mantener una comunicación fluida con el microbiólogo para solicitarle que es lo que estamos buscando, lo que puede llevar a prolongar los tiempo de incubación a 14 días por microorganismos de crecimiento lento como Propionibacterium spp. Solicitar se nos informe sobre el crecimiento de bacterias consideradas habitualmente contaminantes de piel como Corynebacterium spp y Staphylococcus Coagulasa Negativo, ya que estas son los principales responsables de infecciones óseas con material de osteosíntesis.
- El uso de nuevas técnicas como la sonicación del material de osteosíntesis aumenta el rendimiento de los cultivos al liberar del biofilm las poblaciones bacterianas facilitando así su cultivo.
En cuanto a los estudios imagenológicos, la radiografía sigue siendo un pilar diagnóstico que todo paciente debe tener, muestra signos osteolísis en forma tardía luego de dos semanas de iniciado el cuadro y su sensibilidad es baja.
La resonancia magnética es uno de los métodos más sensibles y específicos, mostrando hipointesidad en T1 e hiperintensidad en T2. La tomografía es útil para diagnosticar secuestros.
El PET-TC con 18 fluorodesoxiglucosa, es una nueva herramienta con sensibilidad 96% y especificidad 91%, pero de costo elevado. Las técnicas de medicina nuclear como el centellograma óseo tienen alta sensibilidad con muy baja especificidad, pudiendo lograrse con la marcación con Indio111 aumentarla a 80%.
3) ¿Cómo construir el mejor tratamiento?
El tratamiento es médico quirúrgico y el éxito del mismo depende de:
- Lograr concentraciones del antimicrobiano adecuadas en el hueso, de acuerdo al microorganismo planteado o al aislamiento microbiológico. La concentración de los antimicrobianos en el hueso se representa por un coeficiente entre la concentración del antimicrobiano en hueso y en plasma. Los que tienen mejor concentración son la azitromicina (>1), ciprofloxacina y clindamicina (entre 0,6-0,4) mientras que para los betalactamicos y glucopeptidos es menor (<0,2).
- La oportunidad de su inicio es luego de extraídas las muestras para el cultivo.
- Una duración de 4-6 semanas en cuadro agudos y 6 meses en las OMC parece adecuado. Existen casos de tratamiento crónico supresivo cuando el material protésico no puede ser retirado.
- La cirugía debe ser guiada con criterio oncológico, pudiendo utilizar cementos con antibióticos termoestables para rellenar los defectos óseos.
Debemos considerar terapias adyuvantes, la cámara hiperbárica y la terapia asistida por vacío. Dichas técnicas favorecen la cicatrización, acortan la internación y disminuyen los costos.